- ホーム
- 研究概要
研究概要
メカニカルストレスによる骨格筋可塑性制御

生体には重力,身体運動,拍動,血流などにより様々な物理的刺激(メカニカルストレス)が負荷されており,それらのストレスに応答して,生体機能が調節されていることや,長期的な生体組織の再構築(リモデリング)が行われていることが明らかになってきています.例えば,重力により骨には長軸方向への圧縮応力が負荷されており,関節軟骨では歩行などで生じる静水圧によってコラーゲンなどの細胞外マトリクス産生が影響を受けていると報告されています.逆にメカニカルストレスが負荷されない,あるいは激減する微小重力環境,無動,不活動などでは廃用性筋萎縮が惹起され,骨量の減少(骨粗しょう)が起こります.これらの現象は非常にダイナミックであり,生物学的に興味深いと同時に高齢社会を迎えた我が国における高齢者の寝たきりなどの今日的課題とも関係があります.このため骨格筋等の運動器がメカニカルストレスを積極的に受容して組織の恒常性を維持する仕組みを理解することは,学術的にもまた社会的にも有意義であると考えています.
我々の研究室では,メカニカルストレスがどのように骨格筋の可塑性を制御しているかについて,主に培養細胞と実験動物を用いてアプローチしています.
当研究室による成果
Akimoto et al. Skeletal muscle adaptation in response to mechanical stress in p130Cas-/- mice. Am J Physiol Cell Physiol, 304(6), C541-C547, 2013Horiuchi et al. Mechanical stretch maintains Nanog expression through PI3K/Akt signals in mouse embryonic stem cells. Exp Cell Res, 318(14), 1726-1732, 2012
Akimoto et al. Mechanical stretch inhibits myoblast-to-adipocyte differentiation through Wnt signaling. Biochem Biophys Res Commun, 329(1), 381-385, 2005
ノンコーディングRNAによる骨格筋可塑性制御

我々の研究室では,ノンコーディングRNAによる骨格筋の可塑性制御について,主に培養細胞と実験動物,ヒトサンプルを用いてアプローチしています.
当研究室による成果
Oikawa et al. An inducible knockout of Dicer in adult mice does not affect endurance exercise-induced muscle adaptation. Am J Physiol Cell Physiol, 316(2), C285-C292, 2019Wada et al. MicroRNA-23a has minimal effect on endurance exercise-induced adaptation of mouse skeletal muscle. Pflügers Archiv, 467(2), 389-398, 2015
Russell et al. Regulation of miRNAs in human skeletal muscle following acute endurance exercise and short term endurance training. J Physiol, 591(Pt 18), 4637-4653, 2013
Russell et al. Disruption of skeletal muscle mitochondrial network genes and miRNAs in amyotrophic lateral sclerosis. Neurobiol Dis, 49C, 107-117, 2012
Wada et al. Translational suppression of atrophic regulators by miR-23a integrates resistance to skeletal muscle atrophy. J Biol Chem, 286(44), 38456-38465, 2011
運動がヘルスベネフィットをもたらす分子メカニズム
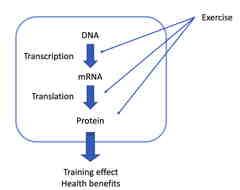
我々の研究室では,運動によるヘルス・ベネフィットの基盤となる分子メカニズムを明らかにするために,主に実験動物とヒトサンプルを用いてアプローチしています.
当研究室による成果
奥津光晴, 秋本崇之. 運動がPgc-1αを介してヘルス・ベネフィットをもたらす分子メカニズムを探る. 臨床スポーツ医学, 30(10), 1283-1287, 2013Aizawa et al. Endurance exercise training enhances local sex steroidogenesis in skeletal muscle. Med Sci Sports Exerc, 43(11), 2072-2080, 2011
Aizawa et al. Acute exercise activates local bioactive androgen metabolism in skeletal muscle. Steroid, 75(3): 219-23, 2010
Akimoto et al. Functional interaction of regulatory factors with the Pgc-1α promoter in response to exercise by in vivo imaging. Am J Physiol Cell Physiol, 295(1), 288-292, 2008
組織工学を応用した骨格筋組織構築
我々の研究室では,組織工学技術を応用してin vitroで骨格筋組織を構築し,これを筋生物学研究に用いるアプローチを模索しています.